新型コロナウイルスSARS-CoV-2(サーズ・シーオーブイ・ツーと読みます)についてのメモです。
1) このウイルスはenvelopeタイプのウイルスとよばれていて、外側に殻envelopeをかぶっているため消毒用アルコールとか、洗剤とかにふれると殻の部分のタンパク質が変性するので不活性化できます。それで70%程度のエタノール消毒(エチルアルコール=エタノールの原液では瞬間に揮発するので変性効果に乏しい)とか手洗いとかが感染予防に大事なわけです。
2) このウイルスはRNAウイルスですがRNAウイルスとしては例外的に、遺伝子配列の変異が少ないです。これはコロナウイルスが遺伝子複製のときに正確に自分のRNAを複製するメカニズム(校正機能 proofreading activity)をもっているためです。(校正機能をもつ酵素proofreading exoribonuclease / Guanine-N7 methyltransferase (ExoN)遺伝子や校正に働くとされるnsp7やnsp8の遺伝子をウイルスのゲノムにもっています。註1参照)。この校正機能が存在するので、今回の新型コロナウイルスは、インフルエンザウイルスで恐れられている激しい突然変異による強毒化する確率は低いのです。しかし最近、校正機能が低下したウイルスがヨーロッパで見つかっているようで注目されています。詳しくは註1とそこにあげた論文を参照してください。これに関しては、抗ウイルス薬として注目されているアビガンの開発者 白木公康先生たちが医事新報に掲載されている緊急寄稿1-3もご覧ください。薬剤耐性のみならず、ウイルスの感染予防についても詳しくわかりやすく書かれていて、大変参考になる内容です。
ところで新型コロナウイルスに感染しない人が存在するのをご存知でしょうか。
以前、ウイルスは糖鎖を介して感染するという話をしました。エイズウイルスにしろコロナウイルスにしろ、ウイルスのタンパク質やウイルスと結合する細胞の受容体(レセプター)には糖鎖がついており、ほとんどすべてのウイルスは糖鎖を介して感染するので、この糖鎖が変化すればウイルス感染に影響を及ぼすことが予想できます。実際、N型糖鎖の合成の最終段階の酵素の一つMOGS (Mannosyl oligosaccharide glucosidase)の遺伝子に異常がある患者さんの場合、患者さんはウイルスに感染しないことがわかっています。この酵素が異常な患者さんでは血中の抗体の量が著しく減少しているのですが(註2参照)、なんとウイルス感染はおこりません。患者さんから取り出した細胞もテストしてみると、ウイルス感染耐性を示します(論文はここhttps://www.ncbi.nlm.nih.gov/pmc/articles/PMC4066413/ からたどれます)。これは、ウイルスのもっているタンパク質のN型糖鎖と、患者さんのもっているウイルス受容体のタンパク質のN型糖鎖が共にこの酵素MOGSの欠損で異常になるため、タンパク質が正しく折りたためず正常な立体構造がとれなくなってしまうためです。ウイルスタンパクが正しく折りたためず正常な立体構造がとれない上に、ウイルスの受容体のN型糖鎖も異常で正しく折りたためないため、ほとんどのウイルスは感染能力を失ってしまうのです。
このようにN型糖鎖が異常になることでウイルスに感染しないという人が存在することが明らかになっています。この例は、糖鎖についてよく理解して研究してその成果を応用すれば、ウイルス感染のない世界がやってくるかもしれないと期待させてくれます。(実際、MOGS酵素の活性を阻害するイミノ糖を与えることでSARS-CoVやエイズウイルスHIV、そしてジカ熱をおこすZika ウイルスなどの培養細胞への感染を抑えられるという論文もでています。)
さて、新型コロナウイルスの糖鎖です。新型コロナウイルスはその一番外側に突出しているスパイクタンパク質が、ヒトの細胞表面にあるACE2という分子に結合、細胞表面のタンパク分解酵素の作用でヒトの細胞膜と融合してウイルスの遺伝情報を細胞に感染させます。
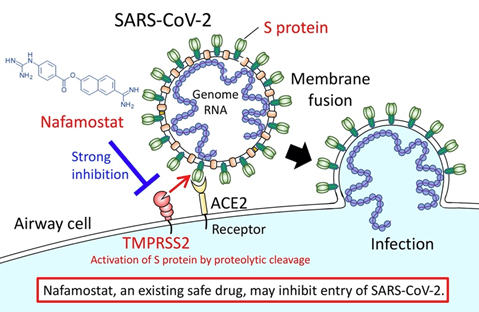 上のわかりやすい図はAMED(日本医療研究開発機構)の研究成果のプレスリリース(2020.3.23)
上のわかりやすい図はAMED(日本医療研究開発機構)の研究成果のプレスリリース(2020.3.23)
Identification of an existing Japanese pancreatitis drug, Nafamostat, as a candidate drug to prevent transmission of SARS-CoV-2 からの引用です。膵炎の治療薬として使われているナファモスタットという薬が新型コロナウイルスの感染を抑える薬として使える可能性を報じています。
図にあるスパイクタンパク質は高度に糖鎖修飾されていて以前紹介したグリカンシールドを作っています。
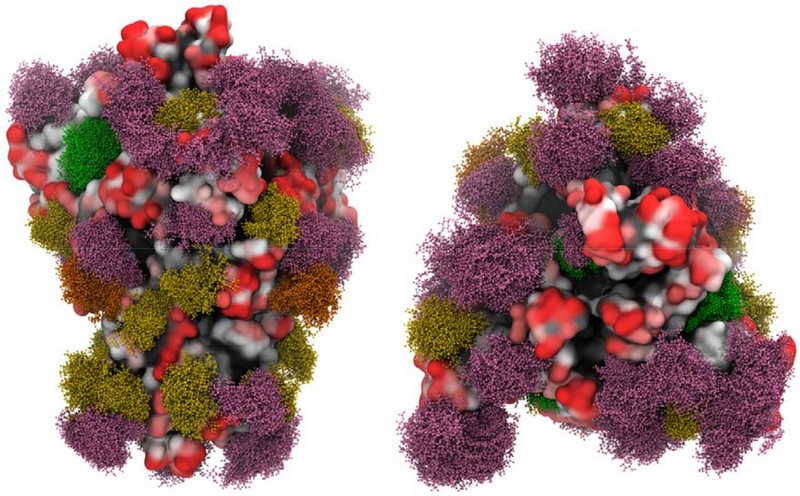
上の図は新型コロナウイルスのスパイクタンパク質の糖鎖を示しています。ウイルスタンパク質の糖鎖はグリカンシールドをつくって抗体の攻撃をかわします。エイズウイルスのグリカンシールドは、抗体による攻撃を免れるのにきわめて有効でワクチンがつくりにくいのですが、新型コロナウイルスの場合は、幸いなことにこのグリカンシールドは不完全であちこちにグリカンシールドの穴があります。
図では一つのスパイクタンパク質を二つの異なる方向からみています。グリカンシールド(N型糖鎖のみ示してあります)の部分はball and stick模型で表示されており、糖鎖の種類によって色分けしてあります。緑がマンノース9個からなるN型糖鎖の部分、濃い黄色がマンノース5つを含むN型糖鎖、オレンジがハイブリッドタイプのN型糖鎖、ピンクが複合型のN型糖鎖です。タンパク質部分での抗体のアクセスしやすさも表示してあって、黒が最もアクセスしにくい部分、赤が最もアクセスしやすい部分です。赤い部分は抗体がアクセスしやすいのでワクチンの標的になり得ることがわかります。こうした糖鎖科学の知識にもとづいて、スパイクタンパク質のどの部分がグリカンシールドで覆われていないかを知って、その部分を標的とした抗体を作れば、有望な新型コロナウイルス予防ワクチンができるはずです。(糖鎖の存在を無視してやみくもに抗体を作ろうとしてもグリカンシールドで覆われているところを標的としてはうまくいかないのです。)この図はBioRxivにあるGrant et alの論文の図1です。https://www.biorxiv.org/content/10.1101/2020.04.07.030445v2.full#F3
グリカンシールドをものともせずにウイルスを攻撃できる抗体というのはあるのでしょうか?その候補の一例についてもBioRxivの論文にでていました。以前流行したSARSコロナウイルスから回復した人の血清中にはウイルスを攻撃する抗体が存在します。その抗体を増やして調べてみると(註3参照)新型コロナウイルスのスパイクタンパク質のN型糖鎖の一つと、その糖鎖がついているタンパク質の一部分(ACE2と結合するreceptor binding domain RBDとは違う部分です)に強力に結合することがわかりました。S309と名付けられたその抗体ともう一つの、同様に得られた抗体を併せて使うと新型コロナウイルスの感染を強力に阻害することができるそうです(記事の末尾のBioRxivの論文参照)。
現在、新型コロナウイルスのスパイクタンパク質と、スパイクタンパク質に結合している糖鎖、そしてグリカンシールドの立体構造の研究が急ピッチですすんでおり、糖鎖を理解することで新型コロナウイルスの感染を抑え込む有力なアプローチとして注目されています。
最新の糖鎖生物学の研究成果によると、新型コロナウイルスSARS-CoV-2は感染するときに、ACE2だけでなく細胞表面にあるシアル酸とも結合して感染していることがわかっています。まずスパイクタンパク質がシアル酸に結合し、その後でACE2と結合するようです。(シアル酸はインフルエンザウイルスの感染でもでてきましたね)また、新型コロナウイルスのスパイクタンパク質のアミノ酸配列にはグリコサミノグリカンとの結合配列というのが見つかっており、グリコサミノグリカンの中でもヘパリンと結合するのだそうです。これは血液凝固阻害で治療によく使われる物質ですので特に重要ですね。またN型糖鎖だけでなくO型糖鎖の果たす役割の研究も進んでいます。こうしたすべての研究は、糖鎖がウイルス感染に決定的な役割を果たしていることを示しています。
註1:ウイルスの複製のときは、RNA合成酵素RdRp(RNA dependent RNA polymerase=ウイルスのRNAを鋳型としてウイルスのRNAを合成する酵素) とnsp 7 (nonstructural protein 7) とnsp8、およびExoNが複合体をつくって校正機能を示すようです。最近、RdRpの変異したウイルスがヨーロッパやアメリカでみつかっており、これは校正機能がうまく働かなくなっているらしいです。校正機能をもつExonN, nsp7, nsp8などとの相互作用がうまくいかないことがその原因と想像できます。そのウイルスでは点突然変異のメジアンが1から3に増えているのがわかったそうです。校正機能が低下して配列に突然変異を多く起こすとそのウイルスは滅びるのでしょうか?あるいは強毒化するでしょうか。もっとも重要な遺伝子の複製酵素が異常になったいわば病気のウイルスですので、どうなるか注目したいと思います。論文はここにあります。
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-020-02344-6
註2:これは抗体の糖鎖修飾が損なわれているため、血中での抗体の寿命が短くなることでおこる現象です。抗体にも糖鎖が結合して重要な働きをしているということを覚えておいてください。
註3: SARSから回復した人の血中にあったメモリーB細胞をEBVウイルスに感染させて不死化して株細胞にした細胞が産生するモノクローナル抗体で、S309と呼ばれています。
より詳しく知りたい人のために―動画と文献の紹介です;
グリカンシールドの研究では、 分子動力学(MD: Molecular Dynamics)による解析(MD解析)が盛んです。スパイクタンパク質のタンパク質部分の立体構造をもとに、それにN型糖鎖付加(どんなN型糖鎖が実際付加されているかもかなり詳しくわかっています。ウイルスが育つ細胞によって糖鎖構造は変化するのですが、どのような糖鎖でもグリカンシールドとしては働くようです)をさせた分子を計算機中にモデル化して、その時間的な動きを計算で追跡していきます(ニュートン力学に基づく分子内の運動の計算を行います)。この方法で、生きている細胞中でグリカンシールドの糖鎖がどのように動いているか、スパイクタンパク質のどの部分がワクチン候補の抗体がねらうべき部分かなどを解析できるわけです。上にあげた図も分子動力学による解析で作成されました。実際SARS-CoV-2のスパイクタンパク質について解析したムービーとしてはNIHで今月初めに開催されたオンラインワークショップのムービーをご覧ください。NIHからダウンロードしたムービーの3時間9分47秒あたりからMD解析の結果の一部がみられます。同じムービーの3時間46分52秒あたりにもMannoseが9個つらなった糖鎖部分M9がスパイクタンパク質のポケット部分に這っていく動画がでていますのでご覧ください。
このオンラインワークショップ“Coronavirus, SARS-CoV-2, & Glycans”は以下のリンクにありますのでダウンロードしてご覧ください。(この原稿執筆時のリンクが、2012年の全く違うビデオリンクになっているのをみつけたので訂正しました。2021/04/20)
https://videocast.nih.gov/watch=37543
最新の糖鎖生物学がどのように新型コロナウイルスと闘うのに役立っているかがよくわかります。下の写真はこのワークショップのオープニング画面のキャプチャです。
 新型コロナウイルスと戦う糖鎖生物学の成果については、BioRxivの論文をみると大いに役立ちます。BioRxivの論文は査読をうけていませんが、しばらくすると有名雑誌に掲載されるものが多数ありますので是非、定期的にチェックしてみてください。たとえばOxford大学のWatanabeらによるBioRxivにでた論文
新型コロナウイルスと戦う糖鎖生物学の成果については、BioRxivの論文をみると大いに役立ちます。BioRxivの論文は査読をうけていませんが、しばらくすると有名雑誌に掲載されるものが多数ありますので是非、定期的にチェックしてみてください。たとえばOxford大学のWatanabeらによるBioRxivにでた論文
Site-specific analysis of the SARS-CoV-2 glycan shield
最近Scienceに査読を終えて以下のリンクに掲載されています。
https://science.sciencemag.org/content/early/2020/05/01/science.abb9983
以下の論文も注目されています。
Analysis of the SARS-CoV-2 spike protein glycan shield: implications for immune recognition:doi: https://doi.org/10.1101/2020.04.07.030445
Structural and functional analysis of a potent sarbecovirus neutralizing antibody
doi: https://doi.org/10.1101/2020.04.07.023903
他にもいろいろあるので検索してみてください。