糖鎖生物学入門―1
今回から糖鎖生物学Glycobiologyについて、ゆっくり解説していきます。九州大学で同名の講義をした時の資料をもとに全く新しく書いていきます。
生物の細胞の表面を眺めてみると、細胞膜の最外層、細胞が外界と最初に相互作用する領域(私は細胞膜のフロンティア領域と呼んでいます)には糖鎖sugar chainがびっしり存在しているのがわかります。たとえばここ やここにある、電子顕微鏡写真をご覧ください。
これらのリンクの写真にみられるように生物の細胞の表面は糖鎖でびっしり覆われています。これを糖衣glycocalyx(グライコ・ケイリクスと発音します。覚えておくとよいのですが、英語では単語の中にあるa という文字は「ア」と発音しないでアルファベットの読みそのままの「エイ」と発音する場合が多いです)と呼びます。細胞は糖のころもを着ているのです。糖衣は細胞の一番外側にありますから、外から細胞に感染するウイルスやバクテリアが最初に接触するのが糖衣の糖鎖です。細胞の最外層の糖鎖の創り出すパターンは、細胞の種類や状態を反映しており、糖鎖パターンが、その細胞のみかけを特徴づけているといってよいでしょう。隣の細胞やリンパ球、そして病原体であるウイルスや細菌が、まず第一に接触するのが細胞表面にある糖鎖です。糖鎖のパターンを認識して細菌やウイルスが好みの細胞に結合したり、病原性大腸菌O157の毒素(志賀毒素、あるいはベロ毒素とよばれています。赤痢菌の毒素と同じものもあります)が腎臓の細胞に結合したりします。もちろん糖鎖は病原体を呼び込むためにあるのではないので、細胞自身も糖鎖の配列を進化させることで、こうした細菌や細菌毒素、ウイルスに感染しないように進化しているわけで、病原菌や毒素、ウイルスと細胞表面糖鎖の共進化はこれからの面白い問題といえるでしょう。これから生命の第三の鎖ともいわれる糖鎖について学んでいきましょう。
タンパク質の多くには糖鎖がついています(糖鎖が付加(ふか)されているといいます)。ウイルス本体の外側に位置するタンパク質も同じで、ほとんどが糖鎖が付加したタンパク質(糖タンパク質)です。一般にウイルス感染は、細胞表面にある糖鎖にウイルスが結合するか、あるいはウイルス表面の糖鎖を細胞がくっつける事で成立します。
さて、この論文には、
https://www.cell.com/cell/fulltext/S0092-8674(16)30401-9
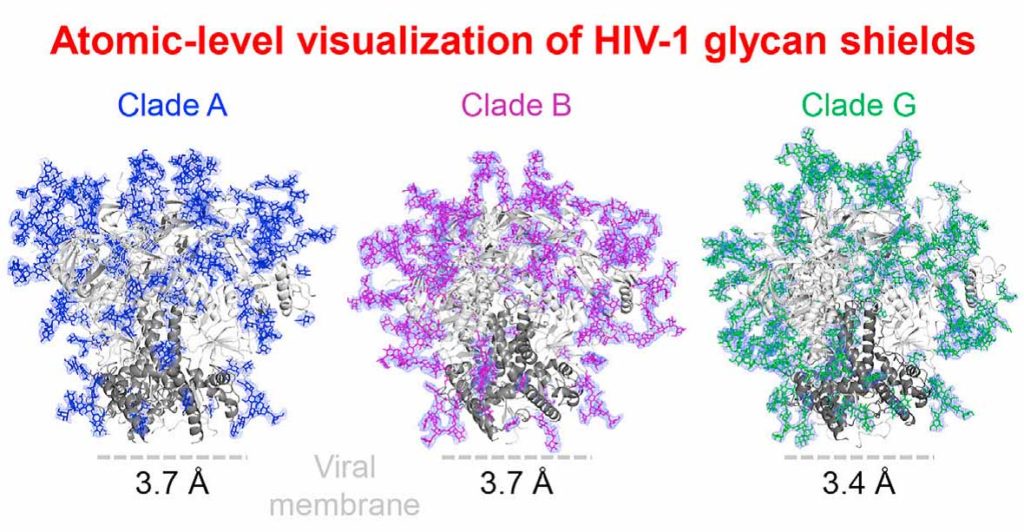
エイズウイルスに対する抗体ができにくい理由であるグリカンシールドの立体構造が述べられています。糖鎖がエイズウイルスのタンパク質部分を被ってバリアーをはっているというイメージですね。このバリアーがあるため、エイズウイルスに対する有効な抗体ができにくいということです。こういった糖鎖によるバリアをグリカンシールドglycan shieldと呼びます。下の図は上のCellの論文(Stewart-Jones et al., 2016, Cell 165, 813–826)
のGraphical Abstractからとったグリカンシールドの様子です。青や紫、緑の部分が糖鎖のグリカンシールドです。
ではこの論文があつかっているグリカンシールドの様子をブラウザで立体構造表示で観察してみましょう。タンパク質の立体構造のデータベースPDBにこの論文のエイズウイルス3量体(注1)に抗体が結合した複合体の立体構造が登録されています。そのうちの一つ、5FYJという名前で登録されている立体構造を見てみましょう。(ほかに5FYK, 5FYLも登録されているので比較してみてください) 以下のリンクをクリックしてブラウザで以下のページを表示してみてください。(表示させている動画が一番下にありますのでみてください)
https://www.rcsb.org/structure/5FYJ
上のリンクをクリックすると、左上に図が表示されています。その直下に3D Viewというのがありますね。その直後にあるStructure という単語をクリックしてください。するとブラウザの画面が変わって、立体構造が画面に表示されます。マウスを左クリックして動かすと立体構造が動くので、複合体の構造をくるくるまわして観察することができます。マウスホイールを回すと構造が拡大、縮小表示されます。またマウスの右クリックでオブジェクトを移動できます。
右側のメニューには、Assembly, Model, Symmetryなどと項目が並んでいます。Styleのプルダウン(初めはCartoonになっています)からSpacefillを選ぶと、スペースフィルモデルでの表示に変わります。Backbone、Surfaceなどいろいろ変えて表示がどう変わるか試してみてください。Ligandのところは、はじめはBall & Stickモデル表示になっています。これは糖鎖の部分を表示していますので、プルダウンからSpacefillを選んでみてください。またマウスを表示したい部分のところにあわせてそっと動かすと、その部分のアミノ酸名や糖の名前が表示されます。MANはαマンノース、BMAはβマンノース、NAGはN-アセチルグルコサミンのことです。
マウスの詳しい使い方はMouse controls documentationという部分をクリックすると表示されます。
以下は、立体構造を表示している動画です。
びっしり糖鎖が三量体のウイルスタンパク質表面に生えているのが実感できます。ナンテンの実のように赤いのが糖鎖です。
今回は、糖鎖のイントロと、糖蛋白質の立体構造をみるやり方の一つを説明しました。PDBは糖タンパク質にかぎらず様々なタンパク質の立体構造が集めてあるデータベースです。いろんな分子を表示してみると面白いです。
註1:3量体というのは、一種類の分子が3つ結合して複合体となり一体として働くものをいいます。2量体なら、2つ結合して一体として働く複合体のことです。エイズウイルスのこのタンパク質は糖鎖付加もされており、実際のウイルス上での状態を忠実に反映する3量体をつくるのに大変苦労したそうです。やっと安定な三量体ができたことから、グリカンシールドと抗体の関係なども解析できるようになり、立体構造もわかってきたそうです。
糖鎖生物学入門―2
糖鎖の構成要素(単糖):
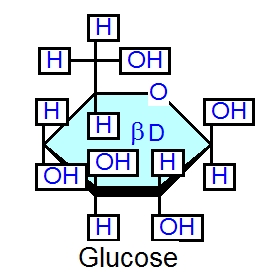
糖鎖sugar chainというのは、単糖とよばれる糖がつながってできる鎖(枝分れするものも多い)です。糖鎖というのは例えばこんなものです。
この図には9種類の糖鎖があげてあります。色のついた丸や四角が単糖monosaccharideを表しており、単糖が様々につながって糖鎖ができるのです。枝分れしたりしていますので、糖鎖はとても多彩な分子構造をとることができそうですね。
単糖というのは、グルコース(ブドウ糖です)とかガラクトースとか、フコースとかN-アセチルグルコサミン(エヌアセチルグルコサミン)とかいう糖で、色々な種類があります。糖鎖について学び始めるときに最初に学ぶべき単糖の名前を下の図にのせておきます。こんな単糖があって、糖鎖をつくっているのだというのをみるのに最適な、入門者むけの単糖だけを選んであります(註1参照)。
この図にのっている単糖の名前や、記号を全部覚える必要はありません。その都度、参照することにしたらいいです。図にある単糖の中でN-アセチルグルコサミンGlcNAc(N-アセチルグルコサミンです。糖鎖生物の研究者は普通、グルックナックと読みます)とか、マンノースMan、グルコースGlc、ガラクトースGalなどの名前はサプリメントの広告とか、日常生活でよく耳にするのではないでしょうか?図には15個の単糖が並んでいますが、たいていの糖鎖はこの図の中の数種類だけを使ってつくられています。単糖の具体的な構造は以下で紹介します。
さて単糖の表記には図にみられるような、カラフルな記号表記が良く用いられています。昔はもっとごちゃごちゃした表記しかなかったのですが、パッと見て糖鎖の構造や類似性がみやすいカラフルな表記が普及しつつあります。Symbol Nomenclature for Glycans (SNFG)と呼ばれる記号表記で、以下のページにまとめられているので参照に便利です。
https://www.ncbi.nlm.nih.gov/glycans/snfg.html
リンクをクリックしてもらって図をご覧になればわかりますが、ものすごい数の単糖がならんでいます。これを全部覚える必要はありません。この図には様々な糖鎖を記述できるようにと、ヒトなどではあまり見かけない単糖も入っているからごちゃごちゃしているのです。そこで次の表には私の独断と偏見で選んだ、入門者に必要な単糖のみを残して後は消したものをあげてあります。(バクテリアにみられる糖とか、希少糖などめずらしい糖―いろんな生理機能も知られて重要性が叫ばれています―を除外しています。)上の図よりちょっと増えて20個ありますが必要に応じて参照していただければと思います。リンク付のpdfファイルもここにありますので参考にしてください。
| Glc | Man | Gal | |||||
| グルコース | マンノース | ガラクトース | |||||
| GlcNAc | ManNAc | GalNAc | |||||
| N-アセチルグルコサミン | N-アセチルマンノサミン | N-アセチルガラクトサミン | |||||
| GlcN | ManN | GalN | |||||
| グルコサミン | マンノサミン | ガラクトサミン | |||||
| GlcA | ManA | GalA | IdoA | ||||
| グルクロン酸 | マンヌロン酸 | ガラクツロン酸 | イズロン酸 | ||||
| Xyl | Fuc | ||||||
| キシロース | フコース | ||||||
| Kdn | Neu5Ac | Neu5Gc | Neu | Sia | |||
| ケーディーネヌ | N-アセチルノイラミン酸 | N-グリコリルノイラミン酸 | ノイラミン酸 | シアル酸(左の単糖から合成される単糖の分子ファミリー名) |
青字の単糖にはリンクがはってありますので、クリックすると単糖の構造式や立体構造が表示されるページにとびます。
こうしたカラフルなSNFG表記の記号は、糖鎖科学の標準的教科書Essentials of Glycobiology 3rd editionでも使われています。(https://www.ncbi.nlm.nih.gov/books/NBK310274/ 書籍版は有料ですが最新版が無料で上のリンクで公開されています。この本の図を全部パワーポイント形式にまとめたスライドも前の記事に書いたように無料で公開されていいます。糖鎖生物学の入門者には、この教科書の通読は必要ありません。せっかくネットにアップロードされていて、本の中身の検索もオンラインで自由にできます(このリンクのSearch this bookボタンを使います)ので、糖鎖学習のハンドブックとして是非活用してください。第二版の日本語訳も出ています。
単糖の構造を立体表示してみよう:PubChemによる表示
PubChemというのをご存知ですか?PubChemはNIHが公開しているオープンデータベースです(だれでも研究データをアップロードできて、だれもが利用できるというのがオープンの意味です)。PubChemを使うと様々な化学物質の情報、生理機能、特許、文献、構造式、立体構造そのほかが無料で調べられ利用できます。糖鎖を構成している単糖の構造を立体表示するにも最適のサイトですので、使ってみましょう。
SNFGのページを開いて以下のリンクから単糖のリストのパワーポイントファイルをダウンロードすると、
全部の単糖が入ったファイルがみられます。上で物凄い数の単糖のリストといったものです。各単糖にはPubChemへのリンクが張られており、スライド表示にして単糖の名前をクリックするとPubCemへのリンクがブラウザで開いて、化学式や立体構造がPubChemで表示されるのでとても便利です。いろいろPubChemで単糖を表示して遊んでみるのが入門にはよい経験になります。グルコースやガラクトースを立体表示してくるくる回して分子模型を手にとってみているように学べます。
注1:図は糖鎖構造を書くソフトGlycoEditorの入力画面をスクリーンショットしたものです。無料の糖鎖構造作図ソフトですので自分で使えそうな人は、ちょっと使ってみるのをお勧めします。詳しい使い方は次回以降に説明します。
糖鎖生物学入門―3
糖鎖生物学入門記事の3回目です。
前回は糖鎖を構成する単位である単糖monosaccharideについて、その表記方法を含めて紹介しました。今回は単糖の構造について学びましょう。
炭水化物とはどんなものだろうか?:
前に紹介した単糖の一つ、グルコースをCarbodraw(註1)というソフトで書いたのがこの図です。赤が酸素原子、水色が水素原子です。
ではこの、このグルコースの水素原子と、水酸基OHを表示してみましょう。
すると、上の左の図のようにグルコース分子では、H(水素)とOH(水酸基)が上に向いたり、下に向いたりと、いろいろならんでいるのがよくわかります。OHやHは炭素からでている(炭素と結合している)ので、炭素の番号も合わせて表示すると上の右の図のようになります。水素のHと水酸基のOHがそれぞれ番号がついたグルコースの炭素にくっついているのがよくわかります。水はH2Oですが、単糖の各炭素原子に水素HとOH基が結合しており、まるで、炭素原子に水がくくりつけられているようにも見えますね。これが炭水化物という名前の由来です。
グルコースなどの単糖も炭水化物に属する化合物です。炭水化物は、分子式がCn(H2O)mという化学式で書けるものの総称です(最新の定義はもっと詳しいのがありますが、入門者にはこの古典的定義で十分です)。英語ではcarbohydrateといいます。hydrateという接尾語の意味は辞書のOxford English DictionaryではA compound of water with another compound or an elementなどと書いてあって、元素や化合物に水が結合した化合物が炭化水素であるということになります。グルコースの場合は、C6(H2O)6ということになり、図をみてみると、確かに一個の炭素あたり、水が一個結合しており、5の番号のついている炭素(5位の炭素といいます)のところだけが、ちょっと他と違っているのがわかりますね。これもこれでなかなか意味がある構造となっていそうですね。1位の炭素と5位の炭素の間は酸素がつないでいますので、5位と6位の炭素のところだけちょっと違うのに気づくと思います。
単糖は図にみられるように環状構造しているものが安定形です。輪を6つの原子でつくっているもの(6員環)と5つの原子で作っているもの(5員環)があります。グルコースは6員環です。酸素の隣の炭素から順に炭素原子に番号が振られています。この番号は、単糖が結合して糖鎖になるとき、何番目の炭素で結合していくかを記述するのに重要ですので、番号がついているんだということだけ覚えておいてください。
アノマー:
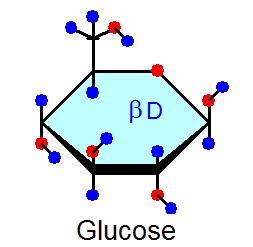
あと、真ん中あたりにβDというのがありますね。これは単糖の立体構造の違いを示すもので、αDのグルコースというのもあります。二つを比べてみると次の図のようになります。
違いはどこかわかりますか。1位の炭素でOHとHの向きが逆向きになっていますね。これだけの違いです。水溶液中ではこの二種類のグルコースが平衡状態で一定の比率で存在することがわかっています(純粋なαD グルコースを水にいれると、一部はβD グルコースに変化する。逆も同じです)。αとβの違いはこんなものです。(1位の炭素C-1がアノマー炭素とよばれ、αとβのタイプの分子はアノマーの関係にあるといいます。)
あとはDですが、Lというのが対になっています。L-glucoseという分子もあるわけです。ただ自然界にみられる単糖はほとんどがD型で、L型はフコースとイズロン酸だけなのでフコースとイズロン酸を描くときだけ注意してあとはD型を書けばよいことになります。
エピマーについて:
グルコースの化学式、C6(H2O)6という化学式をもつ単糖は他にもあります。ガラクトースとかマンノースがそれです。構造がどう違うかは以下の図で確認してみてください。
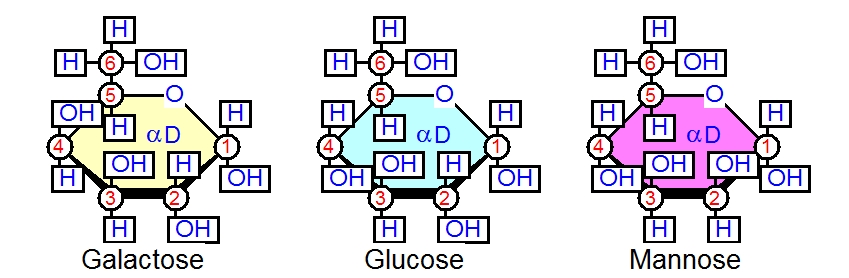
GlucoseとGalactoseの違いは、C-4位の炭素-4のOHとHの付き方ですね。
GlucoseとMannoseの違いは、C-2位の炭素のOHとHの付き方であることがわかります。
たったこれだけの違いですが、生物はこれらの単糖を使い分けているわけで、立体構造の重要性がわかりますね。このように糖の一個の炭素原子の立体配置の異性化したものをエピマーといいます。マンノースとガラクトースは、それぞれグルコースのエピマーです。
註1:Carbodrawについての警告です。糖鎖を描いているソフトはフリーソフトのCarbodrawですが、このソフトをGoogle検索などで探してダウンロードするのは危険ですのでやめてください。このソフトの開発は止まっており、作っていた会社もなくなっています。Google検索で探すと、やばそうなページがいっぱいヒットします。crackだのなんだのというタイトルのページ(このソフトはフリーソフトで登録も不要なもので、crackなど必要なわけがないのですが)があったりして、うっかりクリックすると妙なソフトをダウンロードさせられたり、セキュリティ上の被害を被る可能性もありますので注意してください。(5月1日追記:こちらのページからダウンロードするのは安全そうです。)
https://www.cmbn.no/tonjum/biotools-free-software.html
糖鎖生物学入門―4 アルマ望遠鏡がとらえた、宇宙に存在する糖
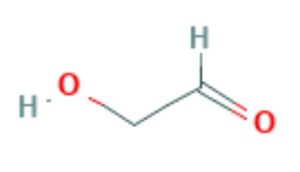
前回は単糖の構造を簡単に紹介しました。炭水化物は一般にCm(H2O)nと表記され、炭素に水がついたような分子という意味で、carbo hydrate (炭・水化物)というのでした。ではm=2でn=2の化合物、C2(H2O)2というのはどんな分子でしょうか。
グリコールアルデヒドという名がついているこの分子は、PubChemでは下図のような構造であると表示されています。 立体構造はこんな感じです。
図の左の構造式をみると、右端にアルデヒド基-CH=Oがあります(註2)。HOCH2-CH=Oいう構造のこの分子は、diose とよばれ (di-は2という意味の接頭語、-oseは糖を示す接尾語ですので、2-carbon sugarとも言われます。二炭糖といいます。註1参照)、体内で重要な代謝産物として働いており、たとえばアセチルCoAに容易に変化することも知られています。
このdioseは実は宇宙に存在しています。その存在を明らかにしたのは、先日ブラックホールの形をとらえた電波望遠鏡システムALMAです。
The Atacama Large Millimeter/submillimeter Array (ALMA) は、南米チリのAtacama砂漠に展開している電波望遠鏡群=アタカマ大型ミリ波サブミリ波干渉計です。上にリンクを張った日本語での紹介ページのトップの「ALMA望遠鏡にまつわる10のこと」の第4番目に「地球外生命の可能性に迫る」という項目があり、そこにグリコールアルデヒドの分子の絵がのっています。説明文にはアミノ酸のことばかり書かれていますが、グリコールアルデヒドは様々な炭水化物のもとにもなる分子です。
発見された場所はIRAS 16293-2422という地球から400光年はなれた連星系のガスの中で、太陽系タイプの星が誕生している現場と考えられているところです。その暖かいガス(200-300K程度の温度だそうです)の中に初めてグリコールアルデヒドが存在することがALMA電波望遠鏡で検出されたのです(論文はここからダウンロードできました)。以下の動画も参考にしてください。
グリコールアルデヒドは上に述べたように最も簡単な糖 diose(二炭糖)であり、ホルムアルデヒドからはじまるホルモース反応(formose reaction)で、触媒の存在下で様々な単糖やリボースなども合成できる素材となる分子でもあります。ホルムアルデヒド(化学式はHCHOでありこれはC(H2O)とかけます)は宇宙空間に存在することがすでに分かっており、グリコールアルデヒドとホルムアルデヒドがホルモース反応をすると三炭糖(グリセルアルデヒドなど)ができあがり、それをもとに様々な糖が合成できるのです。つまり宇宙に、それも太陽系の形成現場にグリコールアルデヒドが検出できたということは、生物によらない触媒で、こうした糖が形成される可能性を補強する発見であり、生命の礎になる炭水化物分子の発見は、宇宙における生命の起源の研究に大きく貢献するというわけです。
最初の有機化合物の一つとして、簡単に糖ができる、というのはとても興味深い可能性です。生命は糖からできたのかもしれない、つまり、RNAワールド云々をするまえに宇宙に豊富な糖の存在が前提としてあって、糖を中心とするタイプの生命がまず最初にできた(RNAの中にも糖がはいっています)可能性すらでてくるわけです。今まで生命の起源の説明に糖を取り込む試みは少なかったのですが、糖鎖生物学者の多くは、RNAワールドより前の糖の形成にこそ、生命の起源を解くカギがあると確信していると思います。
ALMA望遠鏡の日本語サイトには動画ギャラリーもあり、研究者向けサイトととともに大変わかりやすく望遠鏡の全貌を紹介してくれています。本屋に山積みされていた本『スーパー望遠鏡「アルマ」の創造者たち』もおすすめです。ALMA望遠鏡の建設に日本の科学者たちが決定的な貢献をしているのがよくわかります。
註1:炭素が2つ入ってる糖が二炭糖、3つが三炭糖、4つが四炭糖、5つなら五炭糖、6つなら六炭糖です。英語では、di-が2の接頭辞、tri-が3、tetra-が4、penta-が5、hexa-が6の接頭辞ですから、それぞれdiose, triose, tetrose, pentose, hexoseというう名前となります。pentoseはペントースリン酸サイクルというのを生化学で習った人もいるかもしれません。ヘキソースもよく聞く言葉ではないでしょうか。
註2:単糖でアルデヒド基を含むものをaldose (アルドース)、ケト基をふくむものをketose (ケトース)と呼ぶことも覚えておくと良いと思います。glycolaldehydeはaldoseになります。註1とあわせると、aldotetroseとか、ketopentoseというのがどんな物質かがわかると思います。このようにketoseやpentoseに、炭素数を組み合わせた表現もよくみうけます。
糖鎖生物学入門―5 糖鎖を描いてみよう―糖鎖シアリル ルイスxを描いて単糖どうしの結合についての理解を深めよう。
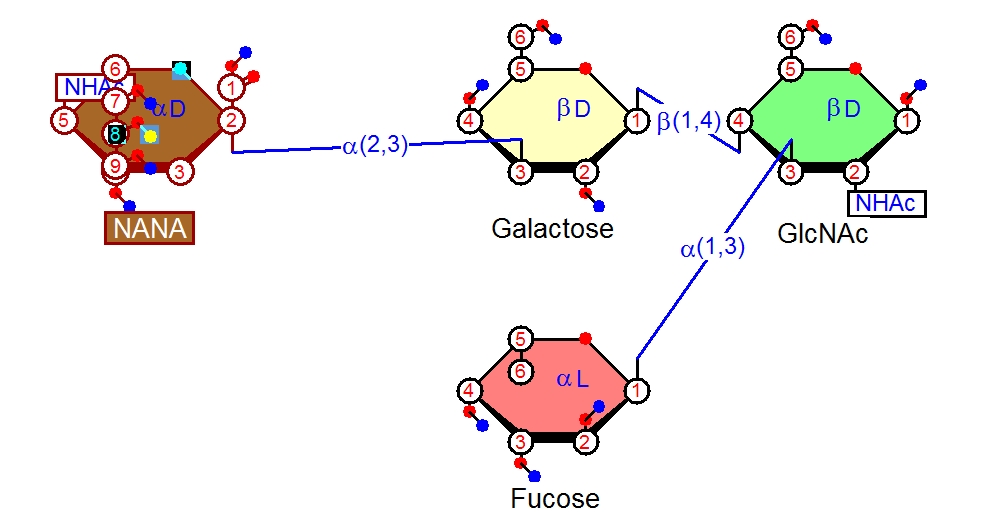
今回は、次の図に示す有名な糖鎖 「シアリルルイスX」(sialyl Lewis x: Lexとも書かれます)を描いてみましょう。このシアリルルイスxという糖鎖は、リンパ球の炎症反応などに関わっていたり、癌組織で増えていたり癌の転移に関わっていたりと大変重要な糖鎖です。
まずシアリルルイスxという糖鎖の構造をネットで調べます。(ルイスxやルイス血液型については註1をご覧ください。)
sialyl Lewis(x)というのをPubChemでしらべてみると以下のように化合物名がでています。
https://pubchem.ncbi.nlm.nih.gov/compound/Sialyl-Lewis_X
ページの中を読んでいくと、
sialyl Lewis xとあって下に様々な表記で同じ化合物を表したものがならんでいます。
Neu5Acα2-3Galβ1-4(Fucα1-3)GlcNAcbβ
α-Neu5Ac-(2->3)-β-D-Gal-(1->4)-[α-L-Fuc-(1->3)]-β-D-GlcNAc
alpha-Neup5Ac-(2->3)-beta-D-Galp-(1->4)-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAc (Neup、Galp、Fucpについては注2参照。pはピラノースの意味です。)
alpha-Neu5Ac-(2-3)-beta-D-Gal-(1-4)-(alpha-L-Fuc-(1-3))-beta-D-GlcNAc
この表示の意味がわかるようになるのが今回の目標です。
今回は上のシアリルルイスxの構造表記をもとに、前に紹介したCarbodrawというソフトをつかって糖鎖を描いてみましょう。このソフトのヘルプに英語ですがシアリルルイスxの書き方がのっています。(最後のD-GlcNAcがαになっている図を描いた例です。)
大学院の講義でこのソフトで糖鎖を描く例としてとりあげていたので、この入門でもやってみようと思います。生物が使っている単糖はたいていはD型ですが、フコースとイズロン酸はL型であることに注意して描いてみましょう。まず以下の表記を使ってみましょう。
alpha-Neup5Ac-(2->3)-beta-D-Galp-(1->4)-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAc
Carbodrawでこの構造を書く方法は以下のとおりです。
まずFucoseとGlcNAcをα(1,3)結合で結びましょう。
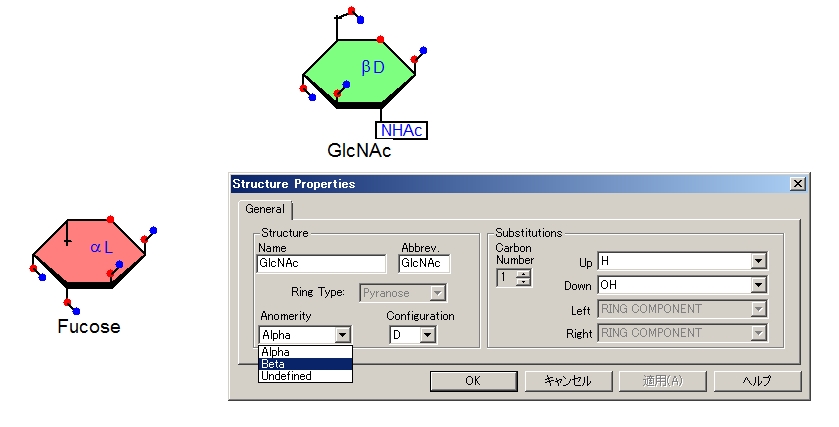
-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAcの部分を描く作業です。デフォルトで表示されるFucose(フコース)はD型になっています。これをL型にかえなくてはなりません。αD Fucoseの上で右クリックして、Propertiesを選択すると下図のような画面がでます。ConfigurationがDになっているのをLに変えて、OKを押すとできあがり。これでL-Fucoseになりました。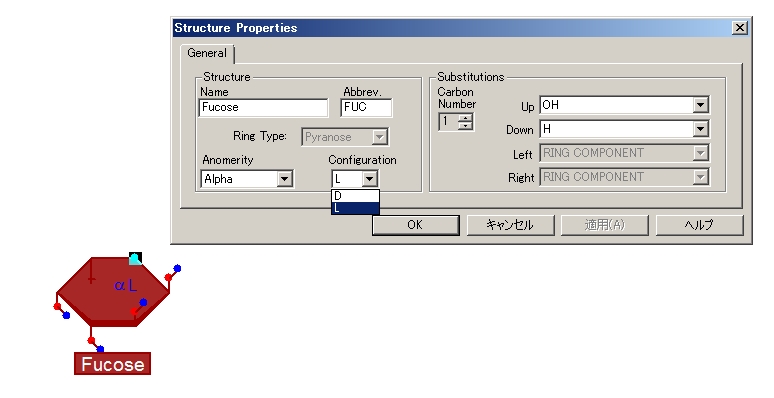
(今回はやりませんが、Anomerityの項目でAlphaとあるところをBetaにするとβ-Fucoseができます。SubstitutionsのUp, Downのメニューを選ぶと、硫酸化とかの修飾も入れることができます。)
次に、-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAcの表記の後半、
beta-D-GlcpNAcを、Fucoseの時と同様にalpha-D-GlcpNAcから作ります。メニューからGlcNAcを選ぶと、デフォルトではα-D-GlcNAcが表示されるので、名前の文字のあたりを右クリックして、Propertiesを選び、Anomerityの部分にAlphaとあるところをプルダウンからBetaにかえてOKを押すとα-D-GlcNAcがβ-D-GlcNAcにかわります。
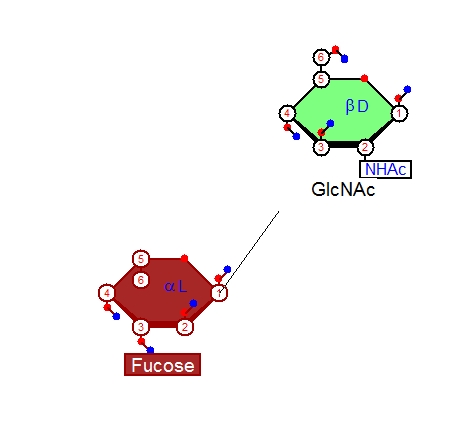
最後に、作ったα-Lフコースと、α-D-GlcNAcをα(1,3)グリコシド結合で結びます。それにはメニューの矢印の隣、魔法の杖のようなマークをクリックします。カーソルが魔法の杖に変わったら、単糖の炭素の番号表示をオンにしておき(炭素の番号表示のオン、オフは➂と書いてあるボタンをクリックして行います)、Fucoseの1番の炭素をこの杖のカーソルでクリックし、ドラッグすると線がマウスカーソルを動かすにつれて伸びていきますので(下図)、GlcNAcの3番の炭素までドラッグしていきます。
フコースの1番炭素からGlcNAc(グルックナック)の3番炭素にちゃんと結合ができると、線が太くなるのでそこでドラッグを止めると結合が描画されます。
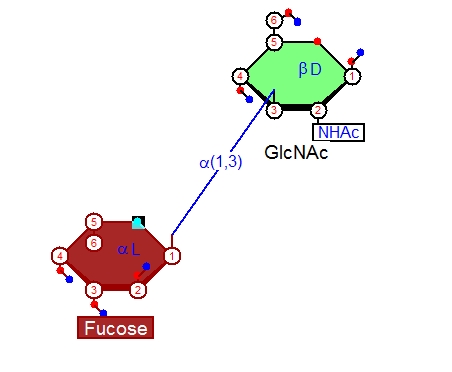
まず一つ結合が書けました。こうして実際にソフトを使って書いてみると[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAc化合物の表示の(1,3)などという表現の意味が良くわかると思います。
次はalpha-Neup5Ac-(2->3)-beta-D-Galp-(1->4)-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAc
の前半、alpha-Neup5Ac-(2->3)-beta-D-Galp-(1->4)-を描きましょう。
CarbodrawのメニューからNANA(Neu5Ac:N-Acetylneuraminic acid=N-アセチルノイラミン酸)を選んでそれをβ-D-Galに結合させます。
まずNANAの結合するGalactoseを描きましょう。Galactoseを選んで図に追加すると、α-D-Galactoseが描かれます。それをβ-D-Galactoseに変えて、(右クリック、PropertiesででるメニューのAnomerityのプルダウンからBetaを選んでOKを押すだけです)、できたものの一番目の炭素を、さきほど作ったβ-D-GlcNAcの四番炭素へ結合させます。
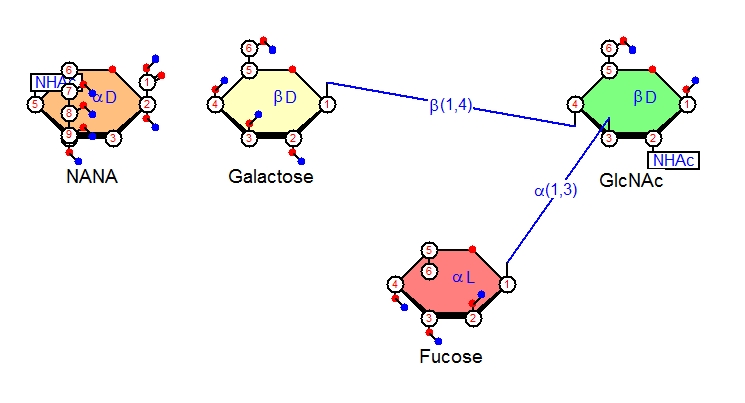
次に、シアル酸のNANAをメニューから選び、図に追加します。これをβ-D-Galacotoseの3番の炭素に結合させます。NANAで炭素の番号を図のように表示するとわかりますが、シアル酸以外の他の単糖(ピラノース型のもの)の酸素(図では酸素は赤丸で表示されています)のとなりの炭素は1番なのに、シアル酸ではピラノースの酸素の隣の炭素の番号は2番になっています。それで普通の単糖の場合1-3結合に相当する結合がシアル酸では2-3結合になるわけです。この炭素の番号づけのずれのために、シアル酸転移酵素(シアル酸をくっつける酵素)はα2-3、α2-6、α2-8というように2番炭素がグリコシド結合に関与する結合表示となります。NANAの2位の炭素からalpha-Neup5Ac-(2->3)-beta-D-Galp-(1->4)-の表記にしたがって、α2-3結合をGalactoseの3位の炭素にむけて作りましょう。これでシアリルルイスx糖鎖が完成です。

自分でいろんな結合をつくってみると、糖鎖の論文にでているα1,3とかいう文言が怖くなくなるでしょう。詳しいやり方は、CARBODRAW/HELP/CARBODRAW.HTMLにありますので、CarbodrawのヘルプメニューからHelp Topicsをクリックして、参照してください。
記号表示では以下のようになります。
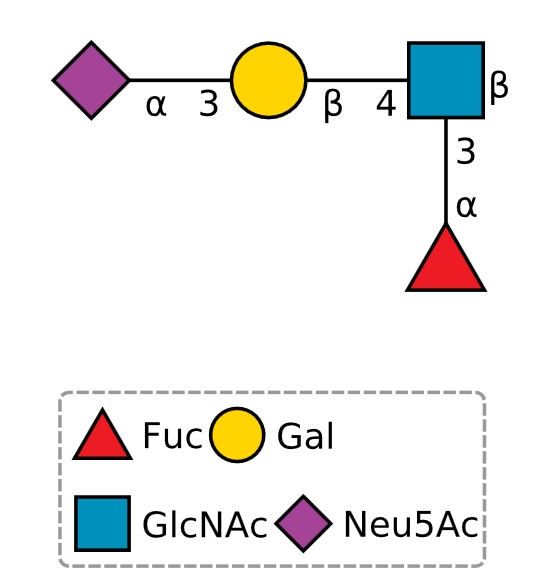
シアル酸の場合、何も書いていときは上に書いたとおり、αのあとには2が略してあると思ってください。それ以外のαやβはα1、β1が略してあるということです。
註1:ルイスエックスという名前にある、ルイス(Lewis)というのは、ルイス血液型という名前に由来します。ルイス血液型をになうのはルイスaとルイスbという糖鎖です。ルイスというのは、この血液型を解明するのに貢献した抗ルイスa抗体を提供したドナーのルイスさんの名前にに由来するのだそうです。LeaやLebの糖鎖は、糖脂質に付加されており、血清に存在する糖脂質が赤血球表面に吸着して血液型物質になっている例です。ルイスa, ルイスbという糖鎖の異性体がそれぞれルイスx、ルイスyという糖鎖です。ルイスxやそれにシアル酸が付加されたシアリルルイスxは赤血球表面には存在していないので血液型物質ではないのですが、リンパ球の表面に存在して炎症反応などに関わっていたり、癌組織で増えていたり癌の転移に関わっていたりと大変重要な糖鎖です。
註2:この表現でのNeupとかGalp、Fucpという表記のpはピラノースの意味です。ピラノースは、O(酸素)を含む6員環の化合物ピランpyranに由来する糖の命名法で、Oを含む6員環構造をとっている糖を指します。furanoseはOを含む5員環の構造をとっている糖を指し、これもOを含む5員環の化合物furanに由来する命名です。
糖鎖生物学入門―6 ABO式血液型の話 その1
今日はABO式血液型の話をします。ABO式血液型の正体は糖鎖です。この血液型は血液型性格判断で話題ですが、本当に性格と関係しているのでしょうか。今回と次回で、その真偽についても考えていこうと思います。
ヒトには色々な血液型があり、血液型をになう様々な物質(血液型物質)がありますが(註1)、あまたの血液型物質の中で一番有名なのはABO式(えーびーおー式)血液型物質でしょう(註2)。輸血のとき必ず調べる血液型です。血液型性格判断でおなじみの血液型でもあります。ABO式血液型は昔(1901年)Karl Landsteiner (ラントシュタイナー)という人が見つけて、1930年のノーベル賞を授賞しています。輸血の時 このABO式血液型の適合性を確認することで、輸血が安全になったので有名です。A型の人の血液の中(血清)には、B型血液型物質に対する抗体があります。B型の血液型の人の血液には、A型血液物質に対する抗体があります。AB型の人の血液にはどちらの抗体も存在せず、O型の人の血液には A型血液型物質とB型血液型物質に対する抗体がともに存在しています。それで輸血(今では輸血には血液そのものではなくて、血液から分離した赤血球を濃縮したものを使います) の時、輸血する血液の血液型を、輸血をうける人の持っている抗体の存在を考慮して選ばないといけないのです。輸血された人の血液中にあるABO式血液型物質に対する抗体が、輸血された赤血球表面の血液型物質と反応するものだった場合、輸血された赤血球は抗体によって架橋されて凝集して血管が詰まったり、腎臓がやられたり、輸血した赤血球が抗体で破壊されたり(溶血です)して、命に係わる事故になることもあるというわけです。
B型赤血球をA型の人へ輸血した場合や(以下B to Aと略)、A to B、A to O、B to Oの輸血の場合こうしたことが起こります。血球でなく血液を輸血した場合にはドナーの血液中の抗体が、輸血をうける人の赤血球を攻撃して破壊しますが、抗体の量が少ない場合が多くマイナーな傷害でとどまることが多いようです。O型の人の血液をA型の人へ輸血した場合―O to Aや、O to B、もちろんA to B、B to Aの場合もこうした攻撃がおこります。
ABO式血液型物質は赤血球表面の糖脂質と糖蛋白質に付加されています(註3参照)
ABO式血液型物質が、ヒトの赤血球表面の糖脂質(糖が結合した脂質です)に存在することを初めて発見したのが2018年10月に亡くなった山川民夫先生です。山川先生の発見の後、箱守仙一郎先生のグループがその糖脂質の構造を明らかにし、さらにABO式血液型物質合成酵素の遺伝子が箱守研究室におられた山本文一郎先生によって同定、クローニングされています。山本先生の書かれた岩波ジュニア新書 811 「ABO血液型がわかる科学」はABO式血液型物質研究の世界的権威が書かれた、ジュニアだけでなく生命科学系の大学院生が読んでもわかりやすく読みごたえのある優れた本です。是非読まれることをお奨めします。
ABO式血液型物質の構造を以下の図に示します。もうちょっとごちゃごちゃした表記も使われることが多いので、それについては私達が書いたこの記事の図もご覧ください。
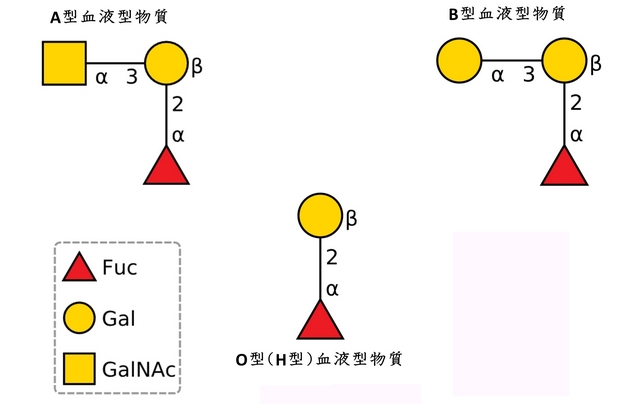
以前にも紹介しましたが、上の記号表記はとてもみやすくて、A型とB型の血液型物質の差が、GalNAc(N-アセチルガラクトサミン、ギャルナック)とGal(ガラクトース、ギャル)の違いだけだというのが一目瞭然です。O型(H型)物質にGalNAcがα1-3で結合したのがA型物質で、Galがα1-3で結合したのがB型物質です。図ではα 3と書かれているだけで、1がないのですが、前回紹介したように1位からでる糖鎖の結合を図で表すときには、1を略すことが多いです。つまりA型とB型の血液型物質の違いはH型血液型物質のガラクトースGalに、α1-3結合でGalNAcがつくか(A型)、Galがつくか(B型)だけの差です。ちなみにGalとGalNAcは以下の図のような違いにすぎません。
 たったこれだけの差ですが、人はこの構造の差を厳然と区別していることに注意してください。これだけの差を生命が区別していることが、輸血事故の原因となっているわけで、糖鎖というものが本当に重要なものだと実感できるのではないでしょうか。これからの回で順次説明しますが、糖鎖は血液型だけではなく、実に様々なところで生命の根幹・基本素子として活躍しているのです。DNA/RNA、タンパク質につづく生命の第三の鎖と呼ばれるだけのことはあるのです。
たったこれだけの差ですが、人はこの構造の差を厳然と区別していることに注意してください。これだけの差を生命が区別していることが、輸血事故の原因となっているわけで、糖鎖というものが本当に重要なものだと実感できるのではないでしょうか。これからの回で順次説明しますが、糖鎖は血液型だけではなく、実に様々なところで生命の根幹・基本素子として活躍しているのです。DNA/RNA、タンパク質につづく生命の第三の鎖と呼ばれるだけのことはあるのです。
さて、話をもとにもどしますが、上の記号表記なら、様々な糖鎖の中のどこにA型血液型物質の三糖があるかはすぐに見つけ出せますね。練習問題として以下の図の中からA型物質のパターンを探してみてください。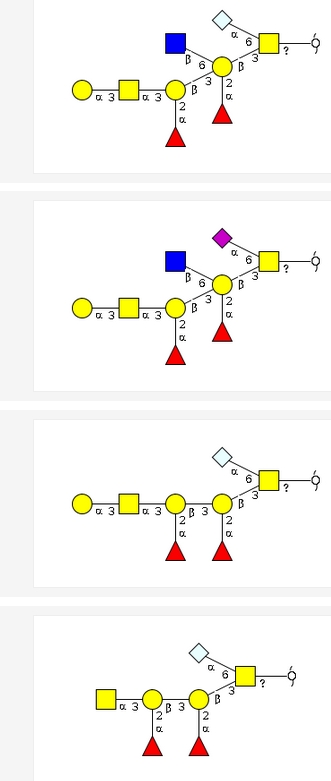
では次の糖鎖はどうでしょうか?一番上のA型物質の表記と比べてみてください。図を裏返しただけに見えますが、どうでしょう?
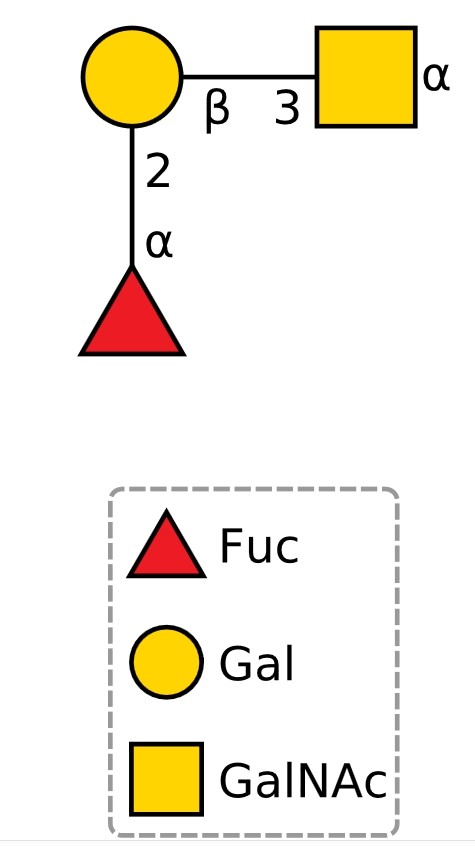
これはA型血液型物質でしょうか?上の図と比較して考えてみてください。
最後にPubChemで血液型物質を表示させてみましょう。ABO式血液型糖鎖の基本であるH型(O型)血液型物質はここをクリックしてください。また B型血液型物質はここをクリックしてください。
A型血液型物質はこちらです。
次回はABO血液型と性格との間に、本当に関係があるのかどうかを真剣に考えてみることにします。
註1:36種類も知られている、人の血液型の一覧はここにあります。
https://www.isbtweb.org/working-parties/red-cell-immunogenetics-and-blood-group-terminology/#collapse-1159-6
いろいろ情報がありますが、その中でも以下のBLOOD GROUP ALLELE TABLES を見てください。
https://www.isbtweb.org/fileadmin/user_upload/Red_Cell_Terminology_and_Immunogenetics/Table_of_blood_group_systems_v6_180621.pdf
註2:ABO式血液型はLandsteinerが1901年に発見したもので、最初はそれぞれの血液型にA,B,Cというアルファベット順の名前を付けたようです。しかしほどなくCという名称の代わりにohne A, ohne B(それぞれ「Aなし」、「Bなし」という意味のドイツ語)という言い方が普及し、ABO式血液型とよぶようになったそうです。O型の人はA型やB型、AB型のヒトと結婚すると子供はヘテロ(AOという遺伝子型やBOという遺伝子型)になるので、heterogenicという意味でO型をH型とよぶことがよくあります。H型というのは血液型の一つでもあり、H型の糖鎖構造の端っこに特定の糖が特定の結合の仕方でついたものがA型やB型の糖鎖構造となります。その意味でH型という血液型はABO式血液型の根幹の糖鎖構造であるわけです。
註3:すべての糖タンパク質や糖脂質にABO式血液型物質の糖鎖がついているわけではなく、糖タンパク質や糖脂質のなかの特定の種類のものにABO血液型物質の糖鎖が結合しているということです。
糖鎖生物学入門―7 ABO式血液型の話 その2 糖転移酵素をゲノムブラウザで調べてみよう!
さて血液型と性格に関係があるかという話です。この問題に関しては、どのような論文がでているのか、文献データベースであるPubMedで検索キーワード ABO blood type personality で検索してみました。すると今日現在で42個の論文がヒットし、関係のない論文も入っていますが、たしかにABO式血液型と性格の関係を論じた論文が公表されているのがわかります。こうした論文を自分で読んで考えられるようにすることを目標にABO式血液型の話を続けます。
今回はABO血液型を決定する遺伝子について調べてみましょう。どんな遺伝子が働いてA型やB型の血液型物質が合成されるのでしょうか。そしてその遺伝子はゲノムのどこにあって、周辺にはどんな遺伝子が並んでいるのでしょうか。まわりにある遺伝子には、もしかしたら血液型と性格の関連を示唆するものがあるかもしれませんね。早速調べてみましょう。
<糖鎖は糖転移酵素が合成する>
糖鎖は通常、単糖をグリコシド結合で連結する酵素(糖転移酵素:英語ではグリコシルトランスフェラーゼ glycosyltransferaseです)を使って合成されます。転移酵素という名前がついていますが、糖転移酵素は糖鎖合成酵素です。糖転移酵素には様々な種類があり、ヒトでは現在240種類ほどの酵素が知られています(CAZYデータベース参照。ケイジ―データベースと読みます。CAZYデータベースに関する動画はこちらをみてください。詳しくは註1参照)。
註1:糖鎖を合成する糖転移酵素や分解酵素など糖に関する様々な酵素が網羅されているデータベースです。ヒトだけでなくバクテリアからC. elegansやショウジョウバエ、ゼブラフィッシュやカエルや植物、マウスなど、さまざまな生物別に糖関連の酵素が網羅されています。
ABO式血液型物質も糖鎖ですから、糖転移酵素によって合成されます。まずO型物質を合成する糖転移酵素を使って、土台のO型物質が合成されます。そのO型物質にGalNAcをα1-3結合させる酵素をGTA、O型物質にGalをα1-3結合させる酵素をGTBと呼びます。この名称に含まれているGTは糖転移酵素glycosyltransferaseの略、AやBは血液型物質を示します。酵素タンパク質であるGTAとGTBはABO糖転移酵素遺伝子(遺伝子名はABO)がコードしています。
<ゲノムブラウザでABO遺伝子を探してみよう>
このABOという名前の遺伝子がヒトゲノム中のどこにあるのかを、ゲノムブラウザで探してみましょう。ゲノムブラウザというのは、いろいろな生物のゲノムの様子を表示してくれるソフトです。オンラインで使えるものが多く、いろいろ種類がありますが、今回は有名なゲノムブラウザであるUCSC genome browser (UCSCというのはUCがカリフォルニア大学 SCがサンタクルーズ分校の意味です)
https://genome.ucsc.edu/index.html
を使ってABO遺伝子を探しだし、この糖転移酵素遺伝子との周辺を眺めみましょう。
上のリンクをクリックして開くトップ画面の
 上段部分にあるGenome Browserの部分をクリックすると以下のページが開きます。プルダウンから選ぶとアジアのサイトを使えetcというページがでて面倒なので最初は単に一回クリックしてください。すると以下のヒトゲノムブラウザのページが開きます。
上段部分にあるGenome Browserの部分をクリックすると以下のページが開きます。プルダウンから選ぶとアジアのサイトを使えetcというページがでて面倒なので最初は単に一回クリックしてください。すると以下のヒトゲノムブラウザのページが開きます。
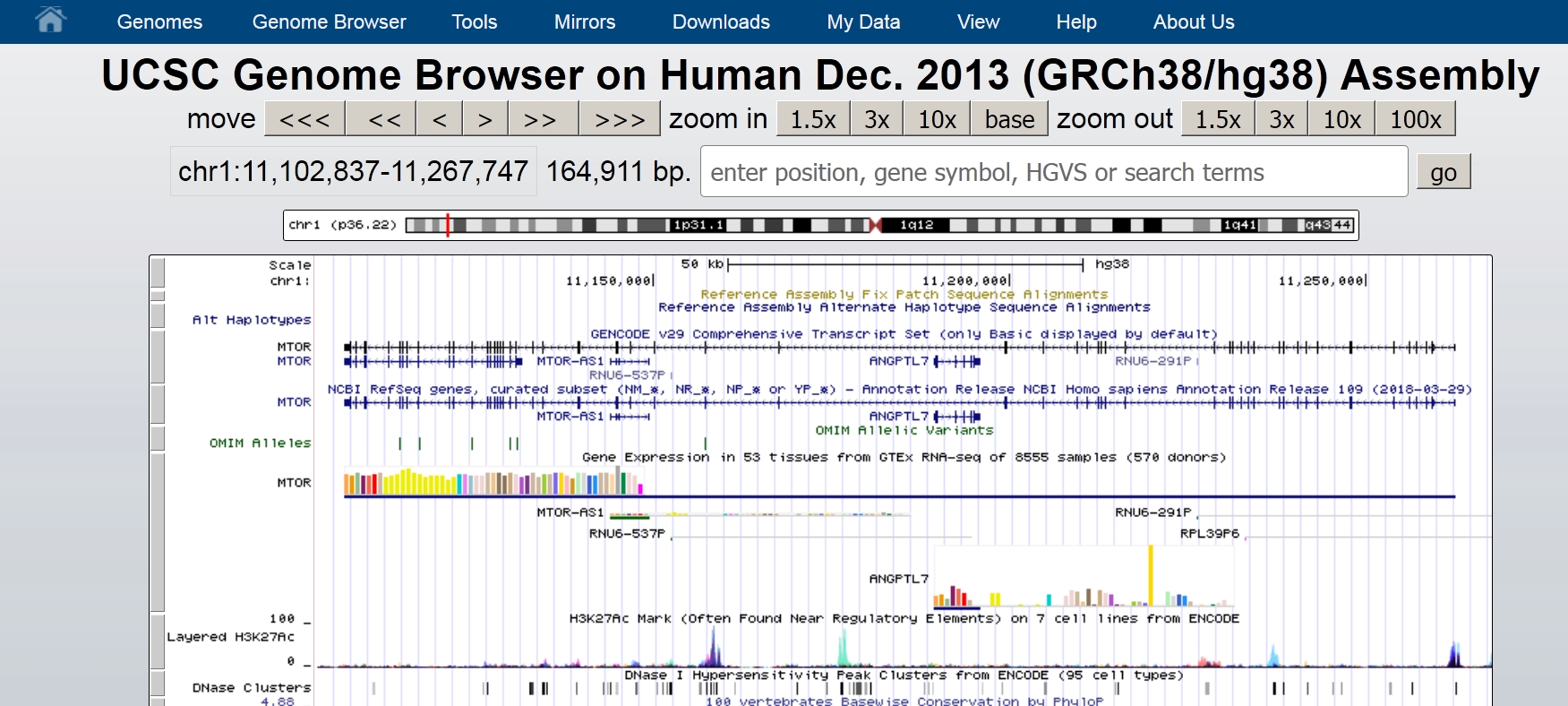 右上にあるgoボタンの左にある検索窓に遺伝子の名前ABOをタイプします。するとポップアップウインドウが 開いて図のように遺伝子のちゃんとした名前が表示されますのでポップアップウインドウの中のABOの遺伝子名(alpha 1,3 GalNAc and alpha1,3 Galtransferaseなどと書いてあります)をクリックします。
右上にあるgoボタンの左にある検索窓に遺伝子の名前ABOをタイプします。するとポップアップウインドウが 開いて図のように遺伝子のちゃんとした名前が表示されますのでポップアップウインドウの中のABOの遺伝子名(alpha 1,3 GalNAc and alpha1,3 Galtransferaseなどと書いてあります)をクリックします。
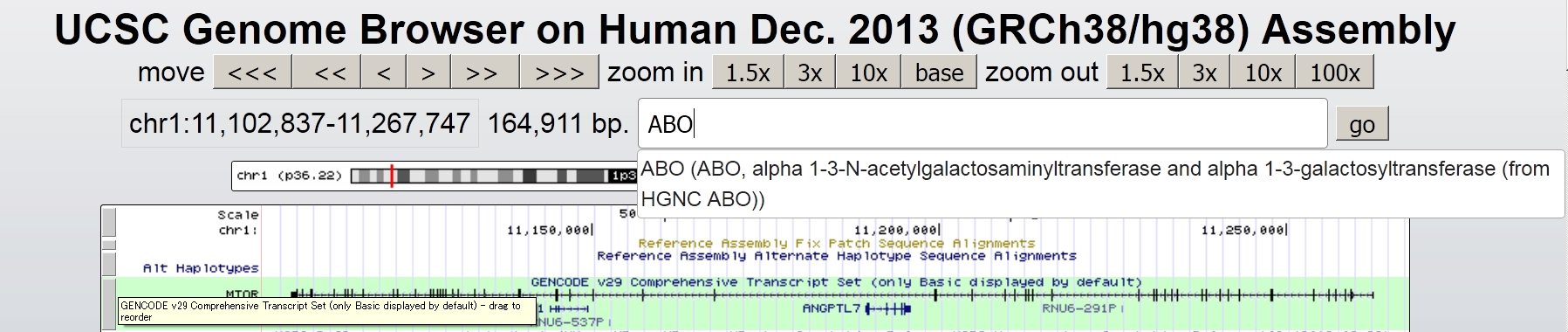 すると検索窓にポップアップの内容が自動記入されますので、右側のgoボタンを押します。すると新しいウインドウでABO 遺伝子が表示されます。
すると検索窓にポップアップの内容が自動記入されますので、右側のgoボタンを押します。すると新しいウインドウでABO 遺伝子が表示されます。
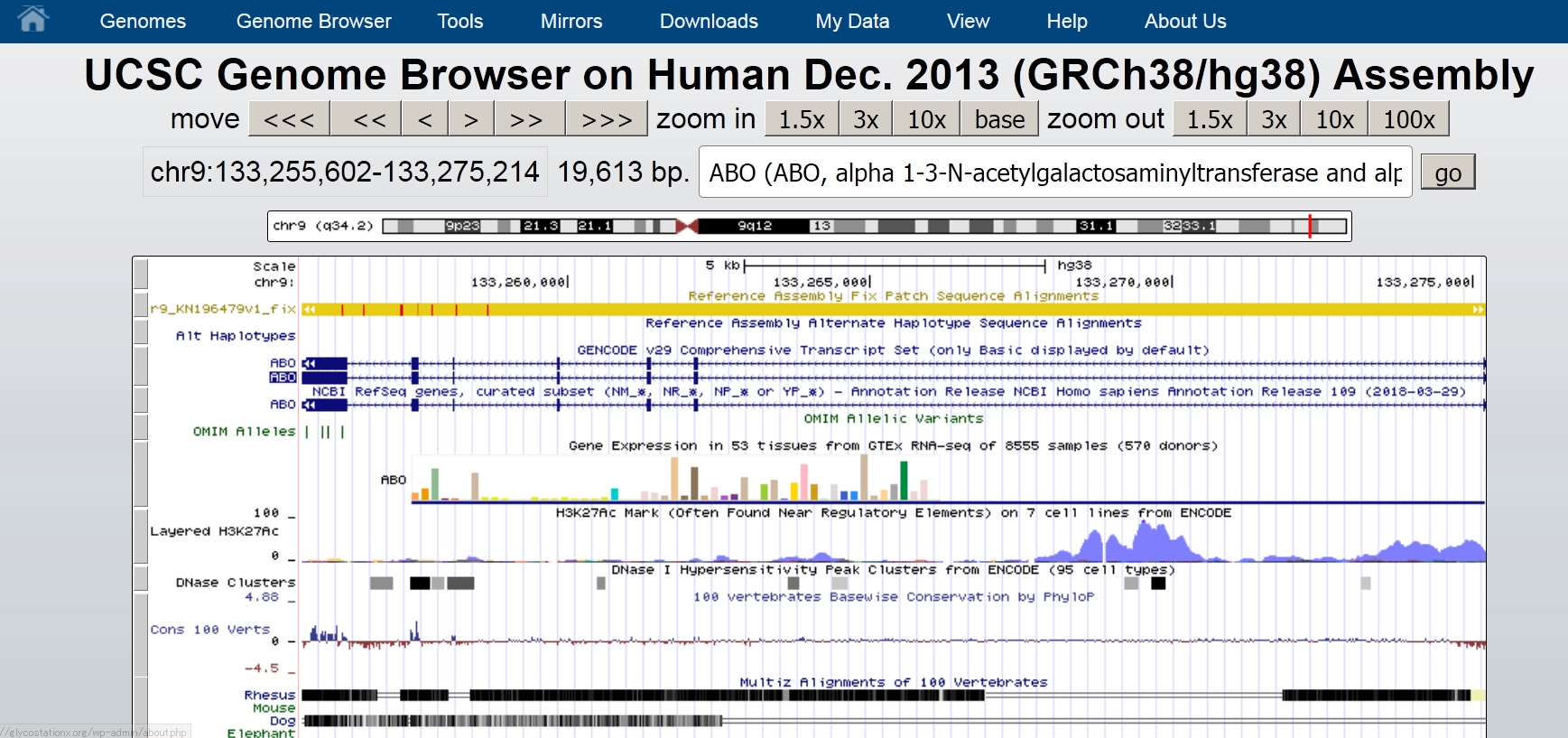 検索窓の下にある帯状の図が遺伝子の存在するヒトの染色体の模式図です。赤枠で囲まれている部分にABO遺伝子があることを示しており、染色体の模式図の下には赤枠で囲んでいるあたりを拡大して表示してあります。染色体の模式図の一番左にはchr9 (q34.2)とありますね。これはABO遺伝子が染色体9番のq34.2の位置にあることを教えてくれています。これでこの遺伝子がヒトの第9染色体のバンドq34.2とよばれる部分にあることがわかりました。このようにして遺伝子名を検索窓に入れて検索すると、検索した遺伝子の存在するゲノム内での位置がわかります。
検索窓の下にある帯状の図が遺伝子の存在するヒトの染色体の模式図です。赤枠で囲まれている部分にABO遺伝子があることを示しており、染色体の模式図の下には赤枠で囲んでいるあたりを拡大して表示してあります。染色体の模式図の一番左にはchr9 (q34.2)とありますね。これはABO遺伝子が染色体9番のq34.2の位置にあることを教えてくれています。これでこの遺伝子がヒトの第9染色体のバンドq34.2とよばれる部分にあることがわかりました。このようにして遺伝子名を検索窓に入れて検索すると、検索した遺伝子の存在するゲノム内での位置がわかります。
染色体の模式図の下にある拡大図ではABO遺伝子のエクソンとイントロンの構造がよくわかります。このABO遺伝子はGalあるいはGalNAcを転移する活性をもっているタンパク質をコードする遺伝子です。この遺伝子は354個のアミノ酸からなるタンパク質をコードしています。354個のアミノ酸の中の、たった4個のアミノ酸の違いでABO遺伝子の産物がGTAの機能(A型物質合成酵素活性)をもつか、GTBの機能(B型物質合成酵素活性)をもつかが決まるのです。O型の人はこの糖転移酵素遺伝子(ABO)の塩基配列の中に停止コドンが入っており、酵素活性のある糖転移酵素が合成できません。このためO型物質にGalやGalNAcが結合せず、土台のO型物質のみをもつO型の血液型になります。ABO遺伝子という名前の糖転移酵素遺伝子ですが、O型物質をつくる酵素活性はもたないので注意してください。
では、この遺伝子の周辺にどんな遺伝子があるかをゲノムブラウザで眺めてみましょう。
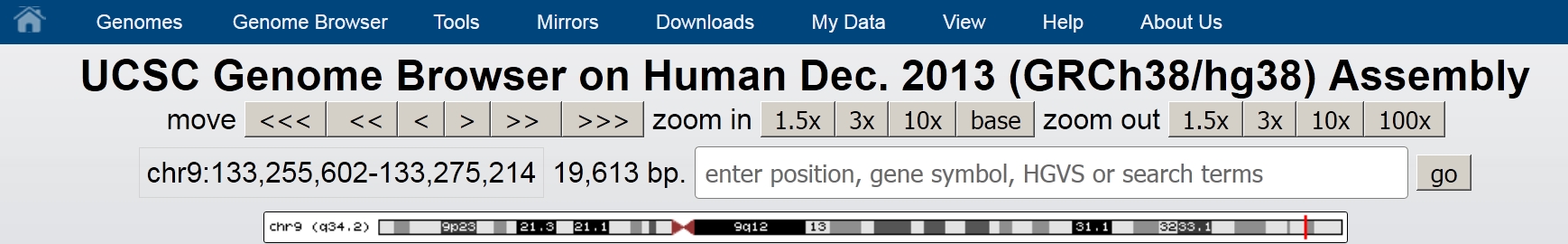 上の図のように開いたゲノムブラウザ画面の上のほうにはzoom in (1.5x 、3x、10x、baseのボタン)とzoom outのボタン(1.5x 、3x、10x、100xのボタン)があります。zoom inのほうのボタンは表示をさらに拡大(遺伝子を大きく拡大表示したりbaseボタンを押して塩基配列を表示)、zoom outのほうは遺伝子をゲノム中でもっと小さく表示して遺伝子の周辺をみるのに使います。
上の図のように開いたゲノムブラウザ画面の上のほうにはzoom in (1.5x 、3x、10x、baseのボタン)とzoom outのボタン(1.5x 、3x、10x、100xのボタン)があります。zoom inのほうのボタンは表示をさらに拡大(遺伝子を大きく拡大表示したりbaseボタンを押して塩基配列を表示)、zoom outのほうは遺伝子をゲノム中でもっと小さく表示して遺伝子の周辺をみるのに使います。
遺伝子の周辺をみたいときにはzoom outのボタンを押します。1.5xを一回押してさらに10xを押すと表示を15倍に拡大というふうに何回かボタンを押してみやすい倍率まで拡大縮小をするのが普通です。
ABO遺伝子の周辺をx10ボタンで拡大表示(zoom out)した例がこれです。
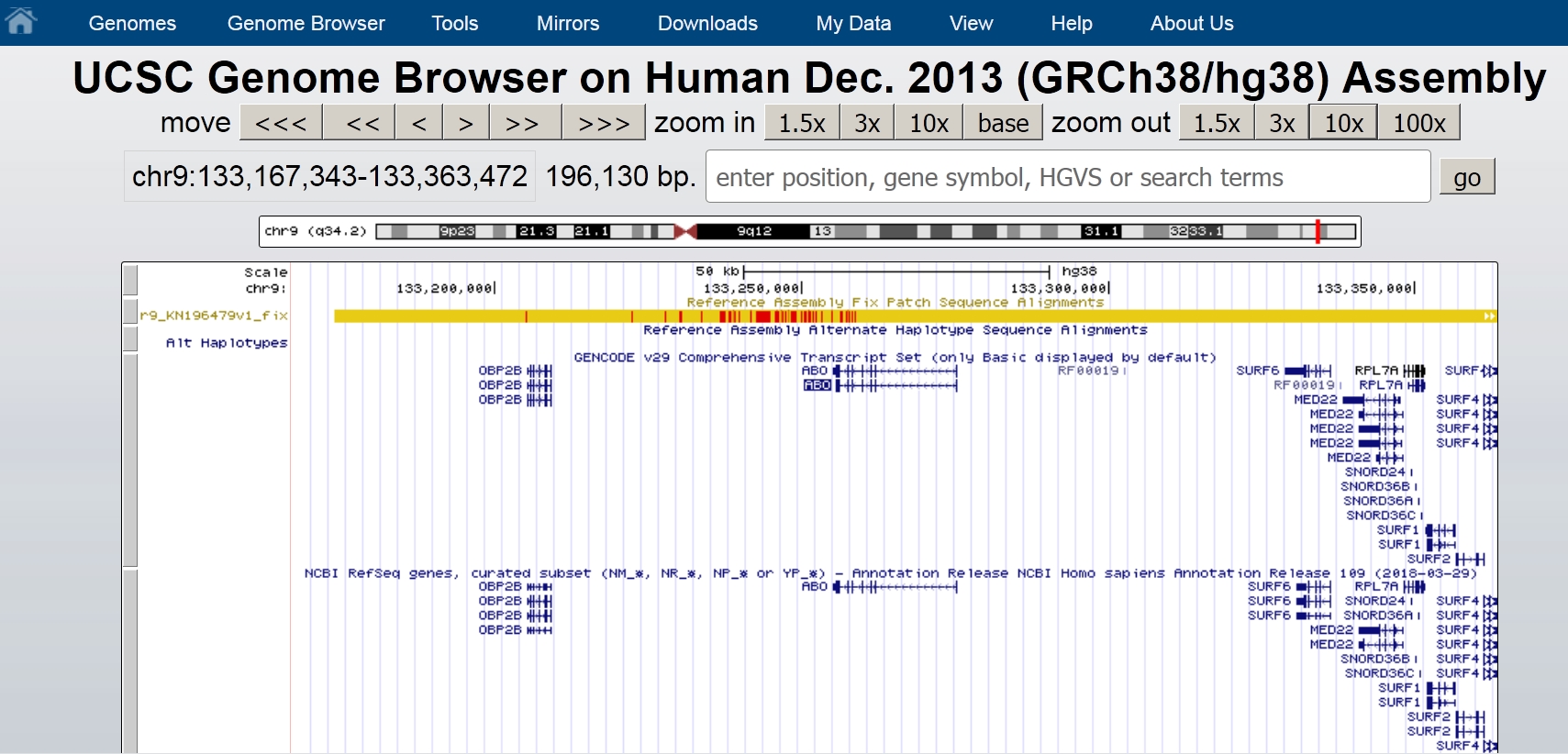 図ではABOの右側にSURF6, MED22その他いろいろな遺伝子があるのがわかります。
図ではABOの右側にSURF6, MED22その他いろいろな遺伝子があるのがわかります。
100xボタンを一回押した画面を下に載せておきます。
 それぞれの遺伝子名をクリックすると、その遺伝子の説明が開きます。100xボタンを押して表示される遺伝子にDBHというのがありますね。これはdopamine beta-hydroxylase (DBH)遺伝子でこの遺伝子がABO式血液型と性格に関連があるという研究のきっかけになったことがある遺伝子です。これが論文です。
それぞれの遺伝子名をクリックすると、その遺伝子の説明が開きます。100xボタンを押して表示される遺伝子にDBHというのがありますね。これはdopamine beta-hydroxylase (DBH)遺伝子でこの遺伝子がABO式血液型と性格に関連があるという研究のきっかけになったことがある遺伝子です。これが論文です。
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0126983
たしかに染色体の同じバンド内にありますね。この論文はGoogle検索してみると出版以来15回ほど引用されています。Web of Science検索では5回でした。
註1:糖鎖を合成する糖転移酵素や分解酵素など糖に関する様々な酵素が網羅されているデータベースです。ヒトだけでなくバクテリアからC. elegansやショウジョウバエ、ゼブラフィッシュやカエルや植物、マウスなど、さまざまな生物別に糖関連の酵素が網羅されています。
隕石に糖が発見されました―宇宙に存在する糖鎖の発見も間近か!
 ニュースでご存知かもしれませんが、日本の東北大学の研究者がNASAの研究者と共同で、有名なマーチソン隕石などの炭素質隕石に宇宙起源の糖を発見したと報告しています。 有名な米国科学アカデミー紀要に発表されたこの論文です。オープンアクセスのようで誰でも読めます。 簡単な日本語の紹介pdfは東北大学のサイトにあります。
ニュースでご存知かもしれませんが、日本の東北大学の研究者がNASAの研究者と共同で、有名なマーチソン隕石などの炭素質隕石に宇宙起源の糖を発見したと報告しています。 有名な米国科学アカデミー紀要に発表されたこの論文です。オープンアクセスのようで誰でも読めます。 簡単な日本語の紹介pdfは東北大学のサイトにあります。
Murchison 隕石は丁度50年前に落下した隕石で今年記念行事が開催されていました。この隕石ともう一つNWA801という隕石の中に、地球に落下してからの汚染ではない、宇宙起源と考えられる糖が複数種類検出されました。Murchison隕石からはすでに宇宙起源のアミノ酸が検出されていましたが、今回RNAや生命のエネルギー通貨といわれるATPその他のリボヌクレオチド、リボヌクレオシドの成分でもあるriboseが検出された他、 コンドロイチンプロテオグリカンやヘパラン硫酸プロテオグリカンのタンパク質とのリンカー部分の構成成分の糖であるxylose(タンパク質中のSer, Thrに結合する)、そしてarabinose、最後にlyxose(これは珍しい糖)が検出できたそうです(なおDかLかという、検出されたそれぞれの糖のキラリティーは決定されていません)。 以前(1962年や1963年の論文―以下の参考論文の項を参照)にも隕石中にglucoseまたはmannose、xylose, arabinoseを検出したという報告がありましたが地球の生物による汚染の可能性が議論されていました。また2001年にNatureに載った論文では、宇宙起源の3単糖であるdihydroxylacetone (ケトースです)が検出されており、同時に各種の糖アルコールも発見されています。しかし5単糖以上の糖は検出されていませんでした。隕石の中に確実に5単糖の存在が検出されたのは初めてで画期的なことです。また今回の論文では、これらの糖鎖がどのような化学反応で合成されたかについても実験を交えて議論しており、おそらくこの糖鎖がformose反応によってできたであろうという推定の実験も行っています(formose反応については、以前の記事も参照のこと)。糖鎖の起源については平林淳先生の以下の論文もご覧ください。
Hirabayashi J. On the origin of elementary hexoses. Q Rev Biol. 1996;71(3):365–80. [PubMed] [Google Scholar]
隕石中の糖についての参考論文:1) Degens, E. T. & Bajor, M. Amino acids and sugars in the Bruderheim and Murray meteorite. Naturwissenschaften 49, 605–606 (1962).
2) Kaplan, I. R., Degens, E. T. & Reuter, J. H. Organic compounds in stony meteorites. Geochim.Cosmochim. Acta 27, 805–834 (1963).
宇宙には前に書いたように炭水化物が検出されていましたが、昔イギリスの有名な天文学者Fred Hoyleが宇宙塵の示す赤外線吸収スペクトルパターンはsporopolleninやポリサッカライド、あるいはバクテリアの外壁の多糖類類似のもの由来であるという説を唱えて論文がNatureに掲載されていました。
HOYLE, F., WICKRAMASINGHE, N. Polysaccharides and infrared spectra of galactic sources. Nature 268, 610–612 (1977) doi:10.1038/268610a0
宇宙由来の糖鎖がついに発見された今、はやぶさ2が小惑星りゅうぐうのサンプルを採取して帰還の途へつこうとしています。ひょっとしたら りゅうぐうのサンプルの中に、世界ではじめて糖鎖が検出されるかもしれませんね。とても楽しみです。(写真は1週間ほど前に撮った金星と木星の写真です)
新型コロナウイルス SARS-CoV-2と戦う糖鎖科学(糖鎖生物学入門 番外編)
新型コロナウイルスSARS-CoV-2(サーズ・シーオーブイ・ツーと読みます)についてのメモです。
1) このウイルスはenvelopeタイプのウイルスとよばれていて、外側に殻envelopeをかぶっているため消毒用アルコールとか、洗剤とかにふれると殻の部分のタンパク質が変性するので不活性化できます。それで70%程度のエタノール消毒(エチルアルコール=エタノールの原液では瞬間に揮発するので変性効果に乏しい)とか手洗いとかが感染予防に大事なわけです。
2) このウイルスはRNAウイルスですがRNAウイルスとしては例外的に、遺伝子配列の変異が少ないです。これはコロナウイルスが遺伝子複製のときに正確に自分のRNAを複製するメカニズム(校正機能 proofreading activity)をもっているためです。(校正機能をもつ酵素proofreading exoribonuclease / Guanine-N7 methyltransferase (ExoN)遺伝子や校正に働くとされるnsp7やnsp8の遺伝子をウイルスのゲノムにもっています。註1参照)。この校正機能が存在するので、今回の新型コロナウイルスは、インフルエンザウイルスで恐れられている激しい突然変異による強毒化する確率は低いのです。しかし最近、校正機能が低下したウイルスがヨーロッパで見つかっているようで注目されています。詳しくは註1とそこにあげた論文を参照してください。これに関しては、抗ウイルス薬として注目されているアビガンの開発者 白木公康先生たちが医事新報に掲載されている緊急寄稿1-3もご覧ください。薬剤耐性のみならず、ウイルスの感染予防についても詳しくわかりやすく書かれていて、大変参考になる内容です。
ところで新型コロナウイルスに感染しない人が存在するのをご存知でしょうか。
以前、ウイルスは糖鎖を介して感染するという話をしました。エイズウイルスにしろコロナウイルスにしろ、ウイルスのタンパク質やウイルスと結合する細胞の受容体(レセプター)には糖鎖がついており、ほとんどすべてのウイルスは糖鎖を介して感染するので、この糖鎖が変化すればウイルス感染に影響を及ぼすことが予想できます。実際、N型糖鎖の合成の最終段階の酵素の一つMOGS (Mannosyl oligosaccharide glucosidase)の遺伝子に異常がある患者さんの場合、患者さんはウイルスに感染しないことがわかっています。この酵素が異常な患者さんでは血中の抗体の量が著しく減少しているのですが(註2参照)、なんとウイルス感染はおこりません。患者さんから取り出した細胞もテストしてみると、ウイルス感染耐性を示します(論文はここhttps://www.ncbi.nlm.nih.gov/pmc/articles/PMC4066413/ からたどれます)。これは、ウイルスのもっているタンパク質のN型糖鎖と、患者さんのもっているウイルス受容体のタンパク質のN型糖鎖が共にこの酵素MOGSの欠損で異常になるため、タンパク質が正しく折りたためず正常な立体構造がとれなくなってしまうためです。ウイルスタンパクが正しく折りたためず正常な立体構造がとれない上に、ウイルスの受容体のN型糖鎖も異常で正しく折りたためないため、ほとんどのウイルスは感染能力を失ってしまうのです。
このようにN型糖鎖が異常になることでウイルスに感染しないという人が存在することが明らかになっています。この例は、糖鎖についてよく理解して研究してその成果を応用すれば、ウイルス感染のない世界がやってくるかもしれないと期待させてくれます。(実際、MOGS酵素の活性を阻害するイミノ糖を与えることでSARS-CoVやエイズウイルスHIV、そしてジカ熱をおこすZika ウイルスなどの培養細胞への感染を抑えられるという論文もでています。)
さて、新型コロナウイルスの糖鎖です。新型コロナウイルスはその一番外側に突出しているスパイクタンパク質が、ヒトの細胞表面にあるACE2という分子に結合、細胞表面のタンパク分解酵素の作用でヒトの細胞膜と融合してウイルスの遺伝情報を細胞に感染させます。
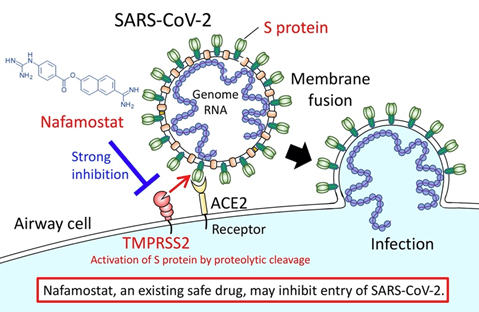 上のわかりやすい図はAMED(日本医療研究開発機構)の研究成果のプレスリリース(2020.3.23)
上のわかりやすい図はAMED(日本医療研究開発機構)の研究成果のプレスリリース(2020.3.23)
Identification of an existing Japanese pancreatitis drug, Nafamostat, as a candidate drug to prevent transmission of SARS-CoV-2 からの引用です。膵炎の治療薬として使われているナファモスタットという薬が新型コロナウイルスの感染を抑える薬として使える可能性を報じています。
図にあるスパイクタンパク質は高度に糖鎖修飾されていて以前紹介したグリカンシールドを作っています。
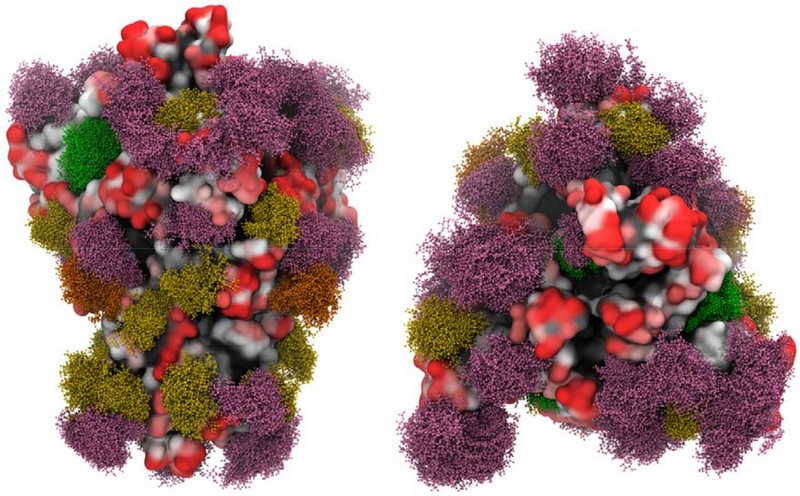
上の図は新型コロナウイルスのスパイクタンパク質の糖鎖を示しています。ウイルスタンパク質の糖鎖はグリカンシールドをつくって抗体の攻撃をかわします。エイズウイルスのグリカンシールドは、抗体による攻撃を免れるのにきわめて有効でワクチンがつくりにくいのですが、新型コロナウイルスの場合は、幸いなことにこのグリカンシールドは不完全であちこちにグリカンシールドの穴があります。
図では一つのスパイクタンパク質を二つの異なる方向からみています。グリカンシールド(N型糖鎖のみ示してあります)の部分はball and stick模型で表示されており、糖鎖の種類によって色分けしてあります。緑がマンノース9個からなるN型糖鎖の部分、濃い黄色がマンノース5つを含むN型糖鎖、オレンジがハイブリッドタイプのN型糖鎖、ピンクが複合型のN型糖鎖です。タンパク質部分での抗体のアクセスしやすさも表示してあって、黒が最もアクセスしにくい部分、赤が最もアクセスしやすい部分です。赤い部分は抗体がアクセスしやすいのでワクチンの標的になり得ることがわかります。こうした糖鎖科学の知識にもとづいて、スパイクタンパク質のどの部分がグリカンシールドで覆われていないかを知って、その部分を標的とした抗体を作れば、有望な新型コロナウイルス予防ワクチンができるはずです。(糖鎖の存在を無視してやみくもに抗体を作ろうとしてもグリカンシールドで覆われているところを標的としてはうまくいかないのです。)この図はBioRxivにあるGrant et alの論文の図1です。https://www.biorxiv.org/content/10.1101/2020.04.07.030445v2.full#F3
グリカンシールドをものともせずにウイルスを攻撃できる抗体というのはあるのでしょうか?その候補の一例についてもBioRxivの論文にでていました。以前流行したSARSコロナウイルスから回復した人の血清中にはウイルスを攻撃する抗体が存在します。その抗体を増やして調べてみると(註3参照)新型コロナウイルスのスパイクタンパク質のN型糖鎖の一つと、その糖鎖がついているタンパク質の一部分(ACE2と結合するreceptor binding domain RBDとは違う部分です)に強力に結合することがわかりました。S309と名付けられたその抗体ともう一つの、同様に得られた抗体を併せて使うと新型コロナウイルスの感染を強力に阻害することができるそうです(記事の末尾のBioRxivの論文参照)。
現在、新型コロナウイルスのスパイクタンパク質と、スパイクタンパク質に結合している糖鎖、そしてグリカンシールドの立体構造の研究が急ピッチですすんでおり、糖鎖を理解することで新型コロナウイルスの感染を抑え込む有力なアプローチとして注目されています。
最新の糖鎖生物学の研究成果によると、新型コロナウイルスSARS-CoV-2は感染するときに、ACE2だけでなく細胞表面にあるシアル酸とも結合して感染していることがわかっています。まずスパイクタンパク質がシアル酸に結合し、その後でACE2と結合するようです。(シアル酸はインフルエンザウイルスの感染でもでてきましたね)また、新型コロナウイルスのスパイクタンパク質のアミノ酸配列にはグリコサミノグリカンとの結合配列というのが見つかっており、グリコサミノグリカンの中でもヘパリンと結合するのだそうです。これは血液凝固阻害で治療によく使われる物質ですので特に重要ですね。またN型糖鎖だけでなくO型糖鎖の果たす役割の研究も進んでいます。こうしたすべての研究は、糖鎖がウイルス感染に決定的な役割を果たしていることを示しています。
註1:ウイルスの複製のときは、RNA合成酵素RdRp(RNA dependent RNA polymerase=ウイルスのRNAを鋳型としてウイルスのRNAを合成する酵素) とnsp 7 (nonstructural protein 7) とnsp8、およびExoNが複合体をつくって校正機能を示すようです。最近、RdRpの変異したウイルスがヨーロッパやアメリカでみつかっており、これは校正機能がうまく働かなくなっているらしいです。校正機能をもつExonN, nsp7, nsp8などとの相互作用がうまくいかないことがその原因と想像できます。そのウイルスでは点突然変異のメジアンが1から3に増えているのがわかったそうです。校正機能が低下して配列に突然変異を多く起こすとそのウイルスは滅びるのでしょうか?あるいは強毒化するでしょうか。もっとも重要な遺伝子の複製酵素が異常になったいわば病気のウイルスですので、どうなるか注目したいと思います。論文はここにあります。
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-020-02344-6
註2:これは抗体の糖鎖修飾が損なわれているため、血中での抗体の寿命が短くなることでおこる現象です。抗体にも糖鎖が結合して重要な働きをしているということを覚えておいてください。
註3: SARSから回復した人の血中にあったメモリーB細胞をEBVウイルスに感染させて不死化して株細胞にした細胞が産生するモノクローナル抗体で、S309と呼ばれています。
さて、グリカンシールドの研究では、 分子動力学(MD: Molecular Dynamics)による解析(MD解析)が盛んです。スパイクタンパク質のタンパク質部分の立体構造をもとに、それにN型糖鎖付加(どんなN型糖鎖が実際付加されているかもかなり詳しくわかっています。ウイルスが育つ細胞によって糖鎖構造は変化するのですが、どのような糖鎖でもグリカンシールドとしては働くようです)をさせた分子を計算機中にモデル化して、その時間的な動きを計算で追跡していきます(ニュートン力学に基づく分子内の運動の計算を行います)。この方法で、生きている細胞中でグリカンシールドの糖鎖がどのように動いているか、スパイクタンパク質のどの部分がワクチン候補の抗体がねらうべき部分かなどを解析できるわけです。上にあげた図も分子動力学による解析で作成されました。実際SARS-CoV-2のスパイクタンパク質について解析したムービーとしてはNIHで今月初めに開催されたオンラインワークショップのムービーをご覧ください。NIHからダウンロードしたムービーの3時間9分47秒あたりからMD解析の結果の一部がみられます。同じムービーの3時間46分52秒あたりにもMannoseが9個つらなった糖鎖部分M9がスパイクタンパク質のポケット部分に這っていく動画がでていますのでご覧ください。
このオンラインワークショップ“Coronavirus, SARS-CoV-2, & Glycans”は以下のリンクにありますのでダウンロードしてご覧ください。
https://videocast.nih.gov/Summary.asp?file=29093&bhcp=1
最新の糖鎖生物学がどのように新型コロナウイルスと闘うのに役立っているかがよくわかります。下の写真はこのワークショップのオープニング画面のキャプチャです。
 新型コロナウイルスと戦う糖鎖生物学の成果については、BioRxivの論文をみると大いに役立ちます。BioRxivの論文は査読をうけていませんが、しばらくすると有名雑誌に掲載されるものが多数ありますので是非、定期的にチェックしてみてください。たとえばOxford大学のWatanabeらによるBioRxivにでた論文
新型コロナウイルスと戦う糖鎖生物学の成果については、BioRxivの論文をみると大いに役立ちます。BioRxivの論文は査読をうけていませんが、しばらくすると有名雑誌に掲載されるものが多数ありますので是非、定期的にチェックしてみてください。たとえばOxford大学のWatanabeらによるBioRxivにでた論文
Site-specific analysis of the SARS-CoV-2 glycan shield
最近Scienceに査読を終えて以下のリンクに掲載されています。
https://science.sciencemag.org/content/early/2020/05/01/science.abb9983
以下の論文も注目されています。
Analysis of the SARS-CoV-2 spike protein glycan shield: implications for immune recognition:doi: https://doi.org/10.1101/2020.04.07.030445
Structural and functional analysis of a potent sarbecovirus neutralizing antibody
doi: https://doi.org/10.1101/2020.04.07.023903
他にもいろいろあるので検索してみてください。